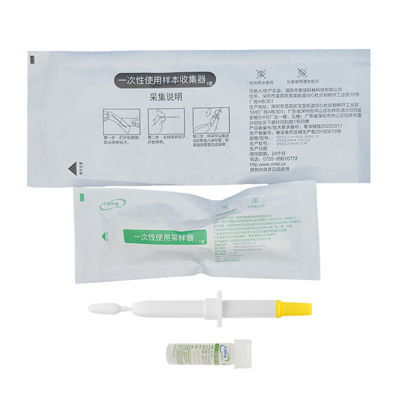
为什么说HPV自取样是未来发展趋势
近日,美国食品药品监督管理局(FDA)宣布扩大两项HPV检测技术的批准范围,允许符合条件的人群在特定医疗环境下通过自取样方式进行宫颈癌筛查。这一举措标志着美国在提升宫颈癌筛查可及性方面迈出重要一步,也为全球宫颈癌防控提供了新的思路。
突破传统筛查模式:自取样的意义
传统的宫颈癌筛查需由医护人员通过盆腔检查采集宫颈细胞样本,但这一过程可能因不适感、隐私顾虑或医疗资源不足而阻碍筛查参与率。据美国国家癌症研究所(NCI)数据,目前约30%的适龄人群未能按推荐频率接受筛查,而HPV疫苗接种率也远低于预期。这一现状在低收入群体、农村地区及少数族裔中尤为突出。
FDA此次批准的两项检测技术——BD公司的Onclarity HPV和罗氏的cobas HPV——允许受试者在医疗机构(如诊所、药店或移动医疗站)内自行使用拭子或刷子采集阴道样本。尽管目前仍需在医疗环境中完成,但这一模式已显著降低了筛查门槛。NCI专家Vikrant Sahasrabuddhe博士指出,自取样能有效解决“医疗荒漠”地区缺乏专业医生的困境,同时尊重个人隐私偏好,为因文化、创伤经历或身体残疾无法接受传统检查的人群提供替代方案。
从诊所到家庭:技术革新推动筛查普及
美国并非唯一探索自取样的国家。荷兰、英国、丹麦、瑞典和澳大利亚等国早已将自取样纳入常规筛查体系,其覆盖率和筛查效率均显著提升。此次FDA的批准,使美国更接近这一国际趋势,而未来的重点在于进一步推广至居家场景。
NCI主导的“最后一公里”(Last Mile)计划正致力于推动这一目标。2024年启动的SHIP试验(Self-collection for HPV testing to Improve Cervical Cancer Prevention)将评估居家自取样的可行性。该试验计划招募来自不同地理、社会经济背景及种族群体的参与者,比较居家自取样与医疗机构采样的准确性,并收集用户对筛查体验的反馈。若结果理想,FDA或将在未来批准居家自取样,从而彻底打破筛查的时间与空间限制。
挑战与机遇并存
尽管自取样潜力巨大,但专家强调,筛查仅是宫颈癌防控链条的第一步。若检测发现高危HPV感染,后续仍需医疗干预以排除癌前病变。然而,对于医疗资源匮乏的人群,这一后续流程可能成为新的障碍。NCI流行病学与遗传学系的Nicolas Wentzensen博士指出:“筛查的每一个环节都可能中断,我们需要系统性解决方案。”
此外,公众认知和政策支持同样关键。例如,如何建立标准化的家庭样本采集与运输流程?如何将自取样纳入医保体系?如何消除对尿液或阴道拭子检测准确性的误解?这些问题的答案将决定自取样能否真正实现“人人可及”。
全球视野下的中国实践
值得注意的是,中国在HPV自取样领域亦取得显著进展。麦瑞科林等企业研发的HPV自采样套装已通过临床验证,其灵敏度与传统医检相当。
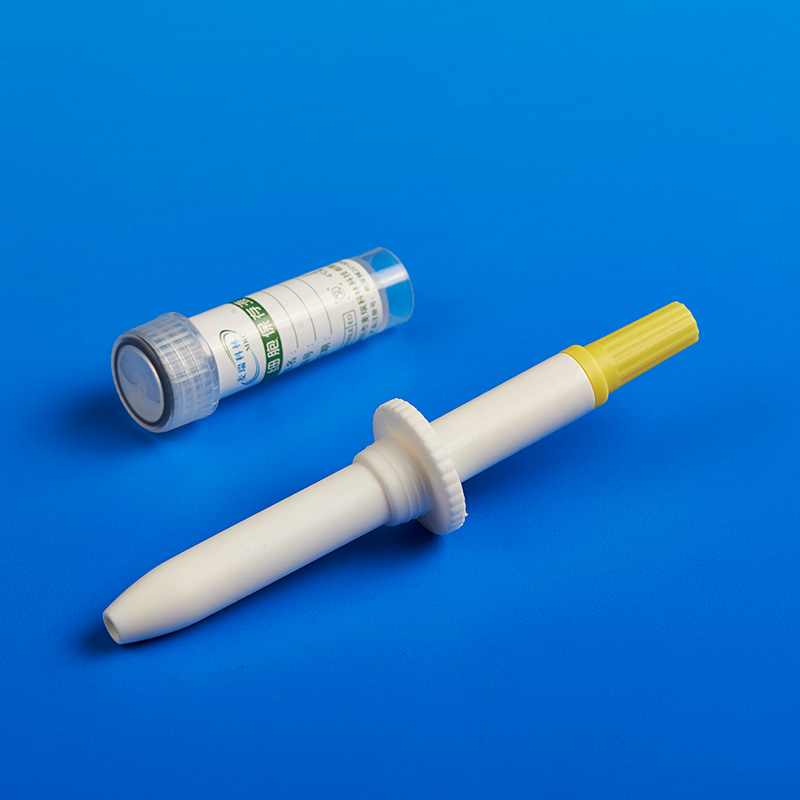
贵州省三都水族自治县的实践表明,结合p16染色分流的自取样模式可将偏远地区的筛查覆盖率提升至89%。深圳等地的创新模式更通过互联网平台和大数据分析,实现了百万级人群的高效筛查。这些经验为美国及其他国家提供了可借鉴的范本。
总结
HPV自取样的推广不仅是技术进步的体现,更是医疗公平与人文关怀的结合。通过降低筛查门槛、尊重个体需求和利用创新技术,自取样有望成为实现WHO“消除宫颈癌”目标的关键工具。未来,随着政策完善和公众教育的推进,这一模式或将彻底重塑全球宫颈癌防控格局,让更多女性在隐私与尊严中守护健康。
文章为麦瑞科林原创,转载请注明文章链接和出处。