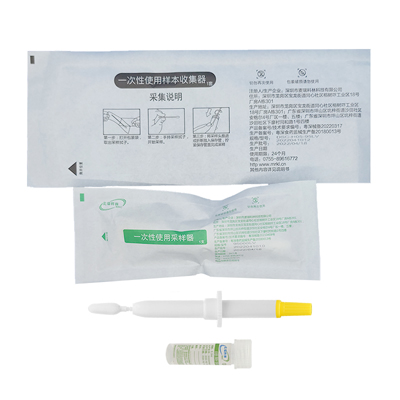
HPV自取样检测试剂将于本月抵达美国医生办公室
首批允许患者自行采集样本筛查人类乳头瘤病毒(HPV)的检测方法之一即将在医生的诊室中使用。
今年 5 月,美国食品和药物管理局(FDA)批准了全球医疗技术公司 Becton, Dickinson and Company(BD)的一种自拭式检验用于 “临床”,即在医生办公室的私人房间、流动诊所或其他医疗机构中使用。
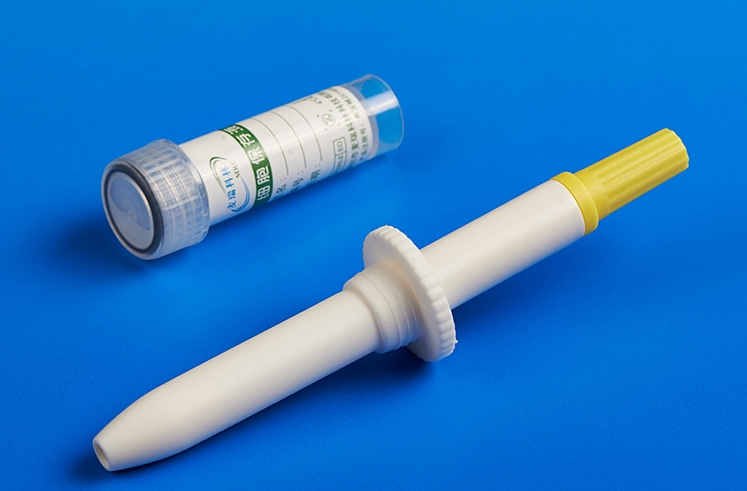
BD公司告诉美国广播公司新闻(ABC News),该公司已于周四开始向医生办公室运送名为 “BD Onclarity HPV Assay ”的自拭试剂盒,试剂盒将于本月晚些时候开始运抵医疗机构。
美国疾病控制与预防中心称,HPV 是美国最常见的性传播感染,可导致包括宫颈癌在内的多种潜在致命癌症。美国疾病预防控制中心说,HPV 每年在美国导致约 36,000 例男性和女性癌症病例。
通常情况下,对患者进行的人乳头瘤病毒筛查包括巴氏涂片检查,也称为巴氏试验。用一个小刷子轻轻地从宫颈表面和宫颈周围清除细胞。然后在显微镜下检查拭子上是否有宫颈癌的迹象或可能导致宫颈癌的细胞变化。
在一份新闻稿中,BD 公司指出,由于各种原因,包括过去的负面经历、社会或宗教偏好,许多人对传统的子宫颈抹片检查所需的盆腔检查感到不舒服。该公司还指出,传统检查可能包括人们必须把腿放在医用蹬子上,或医生选择使用窥阴器。
新的检测方法将允许患者自己插入拭子并采集样本,甚至在初级保健医生的办公室也可以这样做。拭子随后会被送到实验室,实验室会将结果转发给下订单的医生,医生会向病人提供最新信息。
BD表示,有了这种侵入性较小的选择,更多的人,尤其是生活在医疗服务不足地区的人,就可以接受 HPV 筛查,并有可能预防宫颈癌。
“超过一半的宫颈癌发生在过去五年中没有接受过筛查或从未接受过筛查的女性身上,"BD公司诊断解决方案全球医疗事务副总裁、妇科认证医师杰夫-安德鲁斯(Jeff Andrews)博士在一份声明中告诉美国广播公司新闻(ABC News)。“自我采集改变了关于筛查的话题,是在我们有生之年消除宫颈癌的重要一步。它简单、私密且易于使用,所有这些都能帮助那些因社会经济和个人等各种原因而未接受筛查的人获得可能挽救生命的检测。
同样在今年 5 月,美国食品和药物管理局批准了制药公司罗氏控股公司(Roche Holding AG)的一种类似的 HPV 自采测试。罗氏公司告诉 ABC News:"我们的自取装置将于今年秋季开始在提供罗氏 HPV 检测的医疗机构中使用。”
BD 公司表示,该公司最终希望能将其 HPV 自检试剂盒提供给家庭使用,并补充说,这可能会在今年年底前实现,但需要等待美国食品及药物管理局专门针对家庭采集的批准。
麦瑞科林专业为HPV自取样检测试剂提供采样耗材,我们生产的HPV自取样套装广泛应用于各大体检和医学中心。