第三张宫颈癌筛查证!圣湘HPV13+2试剂盒获证!
刚刚圣湘生物发布公告,其HPV13+2检测试剂盒获得宫颈癌筛查资质,这也是目前继凯普生物、德同生物之后的第三家获得HPV宫颈癌筛查资质的IVD企业。
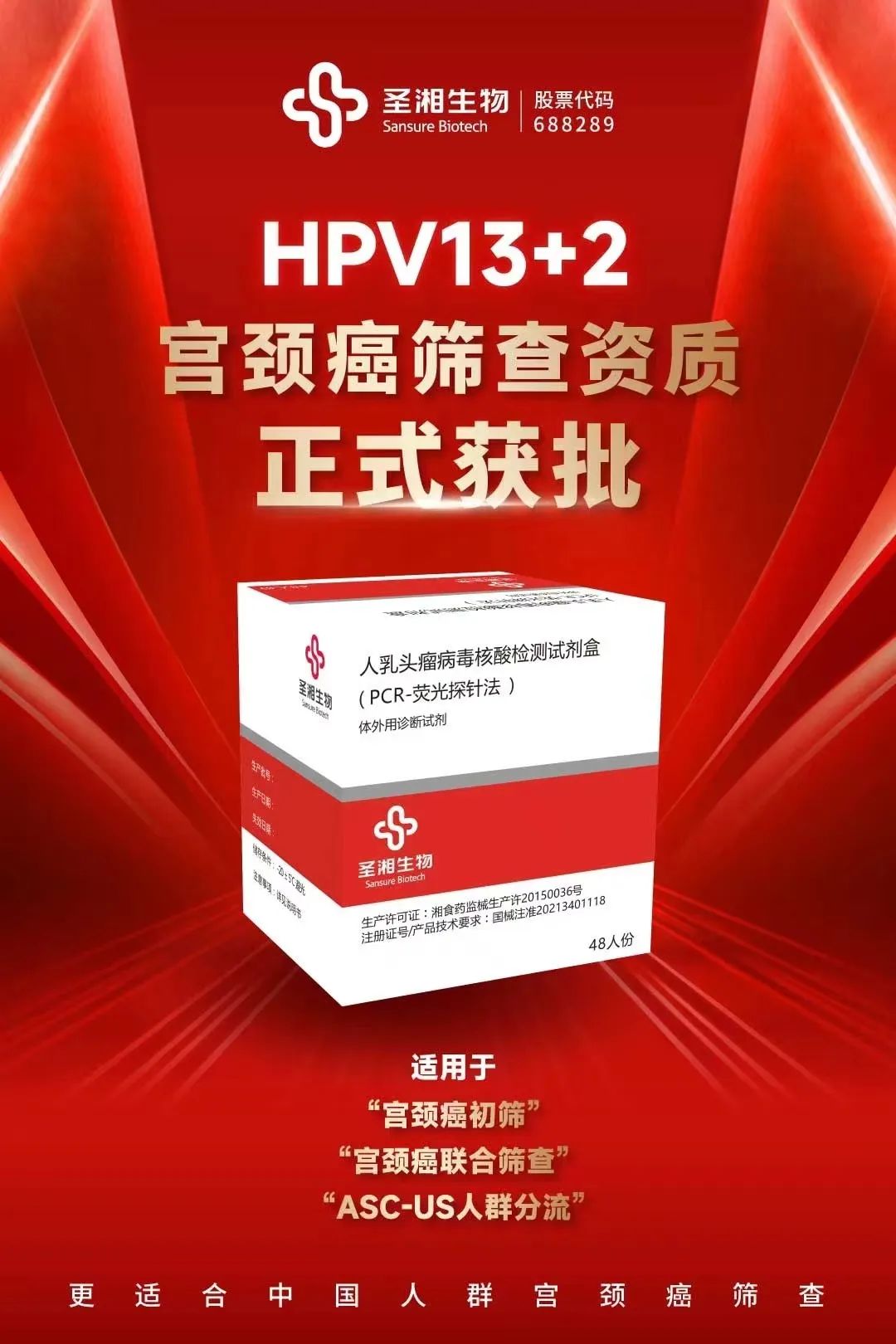
从公开信息可知,圣湘生物的这款人乳头瘤病毒核酸检测试剂盒(PCR-荧光探针法)在2021年获得国家药监局的批准上市,在2024年拿到宫颈癌筛查资质,从产品注册到临床随访预计整体周期>5年。
该试剂盒用于体外定性检测女性宫颈脱落上皮细胞样本中的高危型人乳头瘤病毒(HPV)16型、18型、31型、33型、35型、39型、45型、51型、52型、53型、56型、58型、59型、66型、68型这15种型别的DNA,并能同时分型鉴定高危型人乳头瘤病毒16型、高危型人乳头瘤病毒18型。
2020年11月17日,WHO启动加速消除宫颈癌全球战略,提出到2030年要实现:90%以上的女孩在15岁前接种HPV疫苗;70%以上的女性在35岁和45岁前,至少各接受1次高效筛查;90%以上发现的宫颈癌前病变或癌症的妇女能够得到治疗和管理。
据报道,我国目前宫颈癌筛查覆盖率不足40%,距离消除宫颈癌目标尚存在较大差距!要快速追赶WHO目标,尚需大力推进更加高效简便的筛查技术应用,尤其在目前我国核酸检测能力激增的大环境下,精准、高效的HPV多重荧光PCR技术在宫颈癌筛查方案中应用的可及性得到了更加夯实有力的支撑。
麦瑞科林专业为IVD检测试剂企业提供取样耗材,包括HPV自采样宫颈拭子和HPV保存液。